
Software come dispositivo medico
Quando, come e perché
I software utilizzati in ambito sanitario non devono e non possono essere considerati automaticamente dispositivi medici, ma quelli che ambiscono a tale classificazione devono sottostare a precise normative e regolamentazioni, anche se ancora in via di ultimazione a causa del continuo avvicendarsi sul mercato scientifico di software basati su una sempre più marcata integrazione delle capacità dell’IA nel supportare le attività mediche.

Non è più sufficiente quindi la semplice e precedentemente utilizzata Dichiarazione di Conformità che altro non era che una semplice autodichiarazione.
Definizione di MDSW
Il software quindi può essere qualificato come Medical Device SoftWare (Mdsw) nel caso in cui la creazione o la modifica delle informazioni da esso gestite, come ad esempio creazione, elaborazione, modifica o analisi, sia veicolata ad una destinazione d’uso.
Entrando nello specifico l’applicativo deve soddisfare sia la definizione di software sia la definizione di “dispositivo medico” (Dm) in accordo all’articolo 2(1) del Medical Device Regulation (MDR) (EU) 2017/745 o, in alternativa, la definizione di “dispositivo medico-diagnostico in vitro” (Ivd) dell’articolo 2(2) del Regolamento (Ue) 2017/746“).
L’MDR (Reg. Ue 2017/745 sui dispositivi medici) definisce quando un software rientra nella nozione di medical device (Software As Medical Device – SAMD), chiarendo che tutti i  software che hanno finalità di diagnosi e cura e altresì i software che supportano l’operatore sanitario ad assumere una decisione terapeutica oppure aiutano l’erogazione della prestazione stessa devono essere considerati dispositivo medico (art. 2 lett. a e Allegato VIII regola 11).
software che hanno finalità di diagnosi e cura e altresì i software che supportano l’operatore sanitario ad assumere una decisione terapeutica oppure aiutano l’erogazione della prestazione stessa devono essere considerati dispositivo medico (art. 2 lett. a e Allegato VIII regola 11).
Sulla nuova classificazione del software è stata poi emanata una specifica linea guida dal Medical Device Coordination Group (la “MDCG 2019-11 Guidance on Qualification and Classification of Software in Regulation (EU) 2017/745”).
Come funziona e impatto sui pazienti
Un Mdsw può essere utilizzato “da solo” oppure “in combinazione” e far funzionare o controllare un dispositivo medico (hardware); può inoltre fornire informazioni immediate che inducono a prendere decisioni e fornire supporto agli operatori sanitari. Un software può essere categorizzato come Mdsw indipendentemente dalla sua ubicazione (es. può operare nel cloud, in un computer, in un telefono cellulare ecc.) e dal tipo di utilizzatore finale (un Mdsw può infatti essere usato sia da operatori sanitari che da pazienti o altri utilizzatori non professionisti).
Un dispositivo di questo genere tuttavia, deve agire per il beneficio di singoli pazienti e non deve limitare l’elaborazione dei dati a:
- Conservazione
- Archiviazione
- Comunicazione
- Ricerca semplice
- Compressione senza perdita di dati
Sviluppo di software come dispositivo medico e immissione sul mercato
Nella pianificazione dello sviluppo di software come dispositivo medico, è necessario identificare le direttive e i regolamenti, gli standard e i documenti guida pertinenti consigliati per tale sviluppo, manutenzione e convalida del software medicale secondo lo stato dell’arte.
Il diagramma sottostante contiene i documenti da considerare come punto di partenza. L’esame precoce dei requisiti normativi ridurrà la necessità di rielaborare il software più avanti nel ciclo di sviluppo.

Considerare inoltre chi utilizzerà il software e assicurarsi che l’interfaccia utente sia adatta all’operatore di destinazione; si dovrebbe presumere infatti un linguaggio e una conoscenza differenti in base al software utilizzato direttamente da un paziente o da un medico.
Un Mdsw può essere pertanto immesso sul mercato con le seguenti modalità a seconda della natura del software:
- Se immesso come dispositivo o messo in servizio di per sé deve essere sottoposto a un’adeguata procedura di regolamentazione che tenga conto della qualifica, della classificazione e della destinazione d’uso dell’Mdsw stesso.
- Se immesso sul mercato o messo in servizio esclusivamente come componente/ parte integrante di un dispositivo (hardware) potrebbe non dover essere sottoposto a un proprio processo normativo. In questo caso, l’Mdsw sarà valutato attraverso il processo regolatorio applicato al dispositivo nel suo complesso, nel momento in cui viene immesso sul mercato.
Step qualificativi per MDSW
Per maggior chiarezza, di seguito vengono riportati gli step decisionali per la qualifica di un software come Mdsw. Lo schema è tratto dalla MDCG 2019-11 “Guidance on Qualification and Classification of Software in Regulation (EU) 2017/745 – MDR and Regulation (EU) 2017/746 – IVDR”:
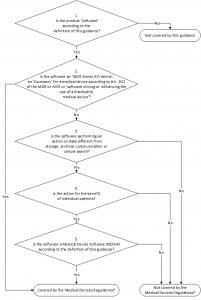
Dispositivo medico o diagnostico in vitro
Un Medical Device SoftWare (Mdsw) che soddisfi la definizione di Dispositivo medico-diagnostico in vitro (Ivd) ricade al di sotto del regolamento (Ue) 2017/746 (Ivdr). A condizione che l’Mdsw sia specificamente inteso dal fabbricante per essere utilizzato insieme a un Ivd al fine di consentirne l’uso in conformità con lo scopo previsto. Tale Mdsw rientra nell’ambito di applicazione dell’Ivdr e deve essere trattato come un Mdsw diagnostico in vitro (Ivd-Mdsw) a pieno titolo.
Nei casi in cui il software permetta il funzionamento o influenzi l’uso di un dispositivo (hardware), il software automaticamente rientrerà nella rispettiva regolamentazione del dispositivo hardware.
Per comodità, riportiamo di seguito la schematizzazione delle fasi decisionali per la qualifica di un Mdsw come dispositivo medico o dispositivo medico-diagnostico in vitro, figura tradda da l’MDCG 2019-11:
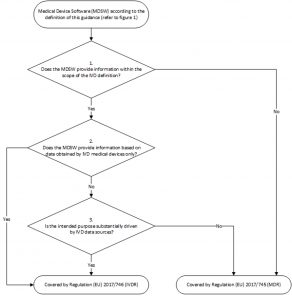
Non sempre un software è un medical device
Il software inteso a far funzionare e influenzare l’uso di un dispositivo medico (hardware) ma senza avere uno scopo medico di per sé (es. software destinato a essere utilizzato per il funzionamento di un analizzatore di chimica clinica), non può essere considerato un Mdsw ma può comunque rientrare nell’ambito di applicazione dei due regolamenti Mdr/Ivdr come parte integrante/componente o come accessorio di un Dm/Ivd.
Risulta quindi chiaro che per qualificare un software come dispositivo medico è necessario eseguire un’indagine approfondita sulle sue modalità di funzionamento e di utilizzo, non risulta quindi solamente sufficiente il fatto che il software sia impiegato nello svolgimento di attività medica.
Ricordiamo anche che in assenza di una specifica destinazione d’uso medica, un software può comunque rientrare nell’ambito di applicazione del MDR se costituisce accessorio di un dispositivo medico, in quanto destinato ad essere utilizzato “con uno o più dispositivi medici, per permettere in particolare che gli stessi siano impiegati conformemente alla loro destinazione d’uso, oppure per assistere specificamente e direttamente la funzionalità sul piano medico dei dispositivi in relazione alla loro destinazione d’uso” (art. 2, n. 2, del MDR).
A cura di Dimitri Corberi (ICT Manager di Sanitanova)
Ti potrebbe interessare:
L’Intelligenza Artificiale in Sanità


